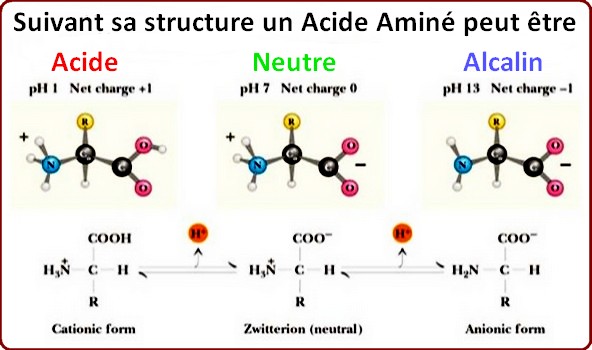
L'acidité, un paramètre bioélectronique de l'acide aminéLes acides aminés sont par essence, amphotères, c'est à dire qu'ils peuvent être, au grès, acides, neutres ou alcalins. Le niveau d'acidité du terrain influe grandement sur la nature électrique de la plupart des acides aminés. Chacun est caractérisé par son point de neutralité acido-basique (Zwitterion). Ce point marque aussi l'équilibre de charge électrique, appelé pHi (pH isoélectrique). A ce pH particulier la charge électrique globale de l'acide aminé est neutre car le groupe amine est exactement à l'équilibre de charge avec celle du groupe carboxyle.
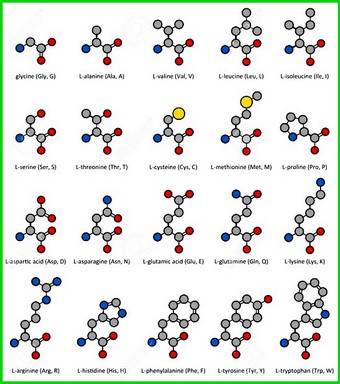
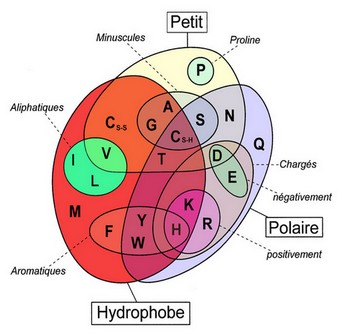
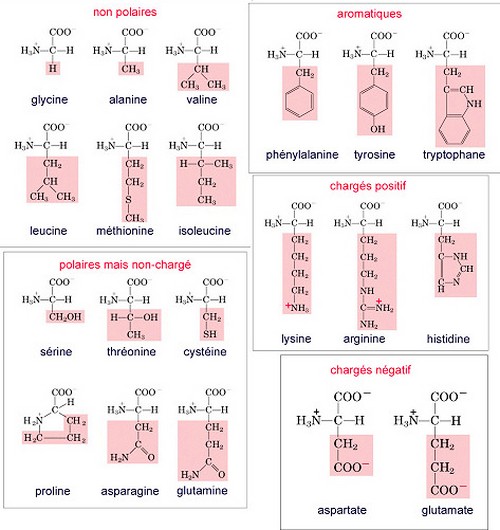
Les 22 acides aminés sont identifiés par leur niveau de charge électrique en fonction du taux d'acidité. Cette identification est représentée par les courbes de titrage.
Les courbes de titrage:
Détermine la charge électrique de l'acide aminé en fonction de son acidité (pH) 
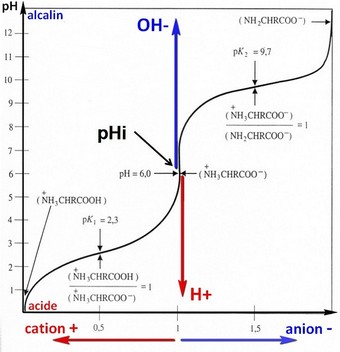
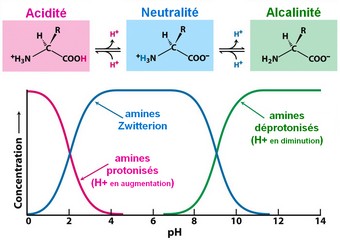
Ce sont les proportions d'ions H+ et d'ions OH- qui fixe la valeur du pH.
Le pH évolue en fonction du taux de protons d'hydrogène (H+), un alcalin est une accumulation ions H+ (protonisation), une base est une diminution d'ions H+ (déprotonisation).
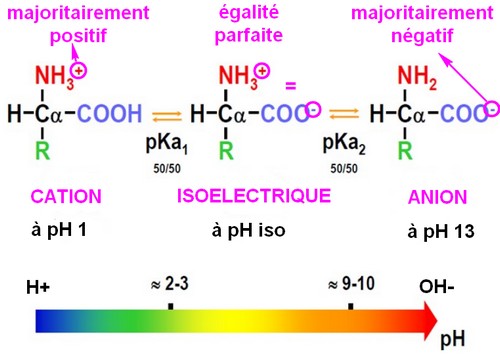
Suivant son degré d'acidité, un acide aminé change son aspect ionique et ses extrémités se polarisent électriquement d'une polarité à l'autre. De cette manière un acide aminé peut adopter 3 états ioniques différents suivant le basculement d'un coté ou de l'autre du pHi (pH isoélectrique de neutralité), point d'équilibre qui marque le pH7 neutre.Voir toutes les courbes de titrage 
C'est le pH qui détermine la polarité de l'acide aminé.
Lorsque le pH est inférieur au pHi, c'est à dire acide, l'acide aminé devient cation, à l'inverse lorsque le pH est supérieur au pHi, donc alcalin, l'acide aminé devient anion.




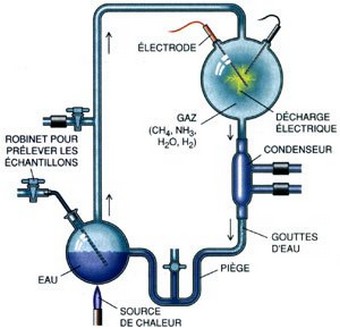
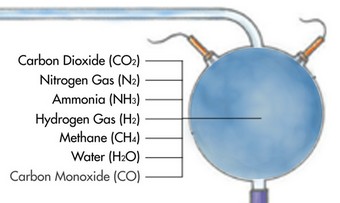
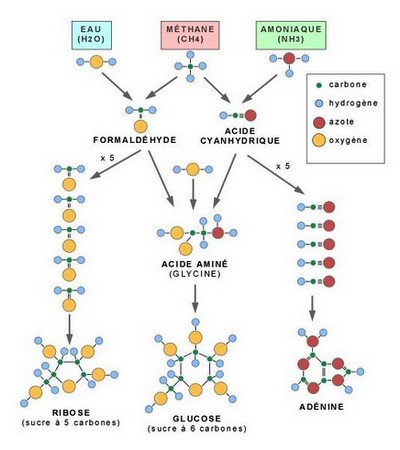
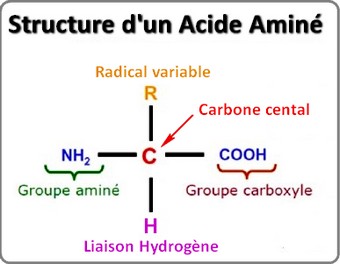
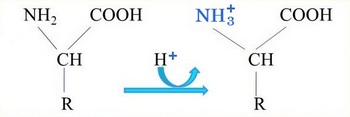
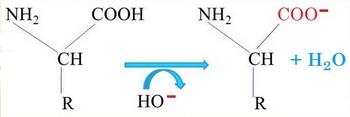 En milieu alcalin le groupe carboxyle (COOH) s'ionise en perdant un proton (H+) et devient donc négatif
En milieu alcalin le groupe carboxyle (COOH) s'ionise en perdant un proton (H+) et devient donc négatif